#患者姓名:王**
#性别:女
#年龄:29岁
#主诉:结婚5年未避孕未孕。
#现病史:诉2013年结婚,夫妇性生活正常,未避孕至今未孕(知识点1)。2012年外院HSG示输卵管梗阻,遂行宫腹腔镜手术治疗,术后仍未孕。2014年12月外院ICSI-ET助孕(知识点2)(采用超长方案,获卵9只,受精障碍,行RICSI助孕(知识点3),移植2只胚胎)未孕,2015年10月该院再次ICSI-ET助孕(采用长方案,获卵11只,移植2只胚胎)助孕均未孕,诉外院助孕示卵子成熟度低,透明带异常。今来院要求试管婴儿助孕。近一月,精神、食欲、睡眠可,大小便正常,体力体重无明显变化。
#既往史:否否认药物、食物过敏史,认高血压、糖尿病、甲状腺、冠心病、肾病、脑血管病等病史,否认肝炎、结核等传染病史。否认外伤史。否认手术史。
#个人史:否认疫区、疫水接触史。否认毒物,放射性物质接触史。男方有抽烟饮酒史。
#婚育史:无特殊,适龄结婚,配偶体健。
#家族史:遗传性疾病史。
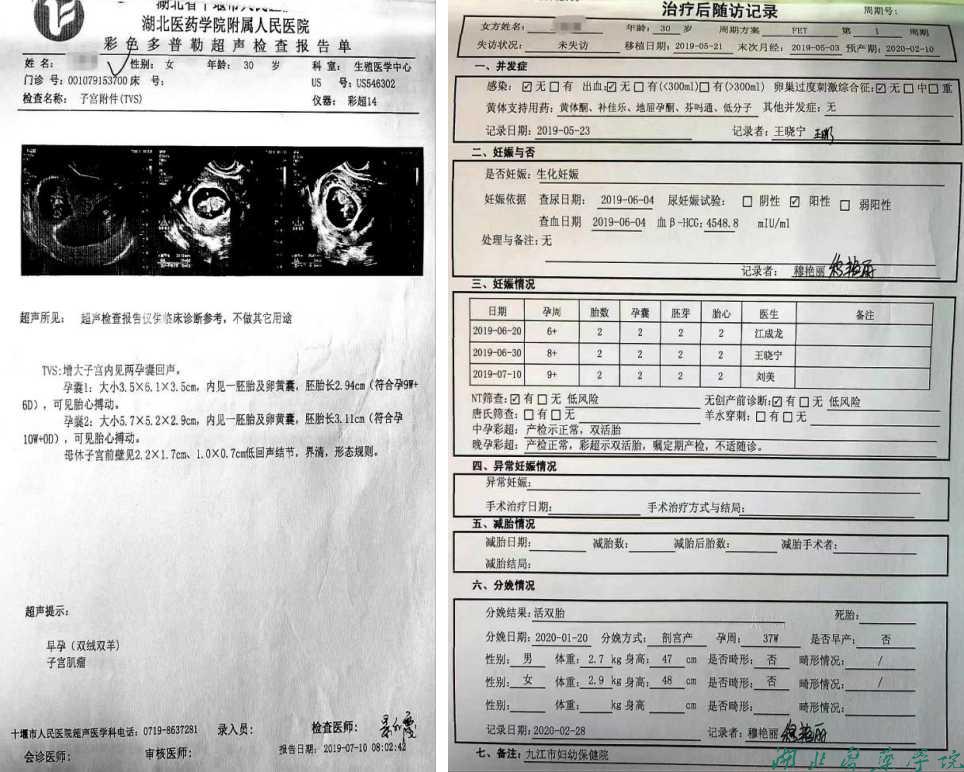
#专科检查:T 36.4℃ P87次/分R18次/分HP 107/76mmHg。体重64kkg,身高163cm,妇科检查外阴,阴道正常,宫颈光滑,子宫前倾,大小正常,内膜厚度5.0cm。妇科B超左侧12个,右侧15个。
#辅助检查结果:
男女双方染色体结果分析正常(图1)
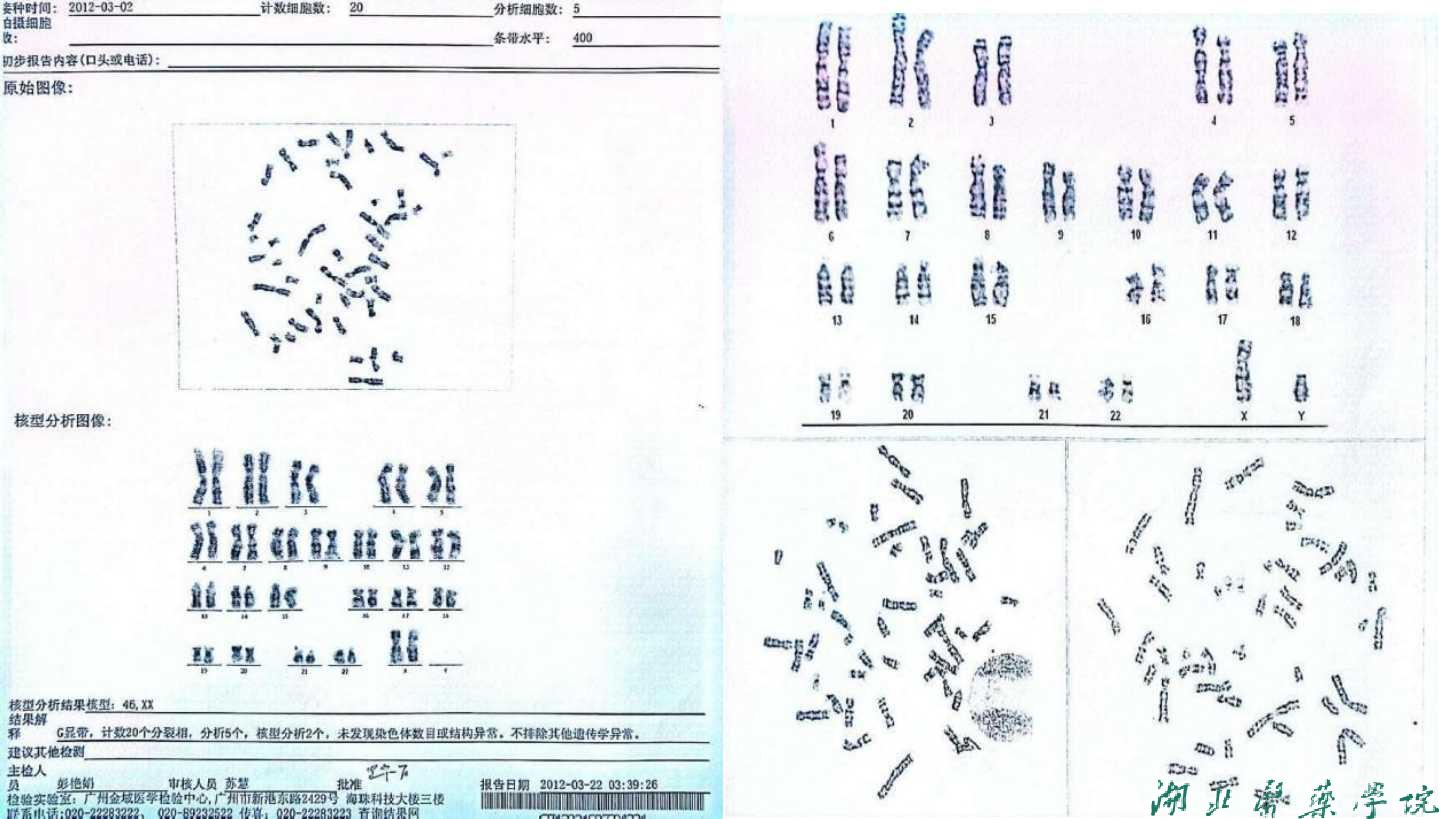
女方染色体 男方染色体
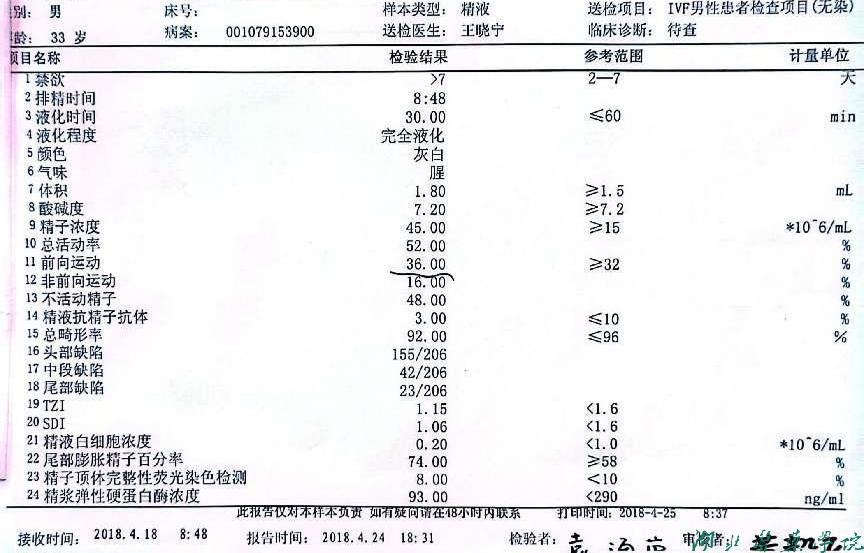
男方精液报告检测(图2)
女方性激素检测(图3)

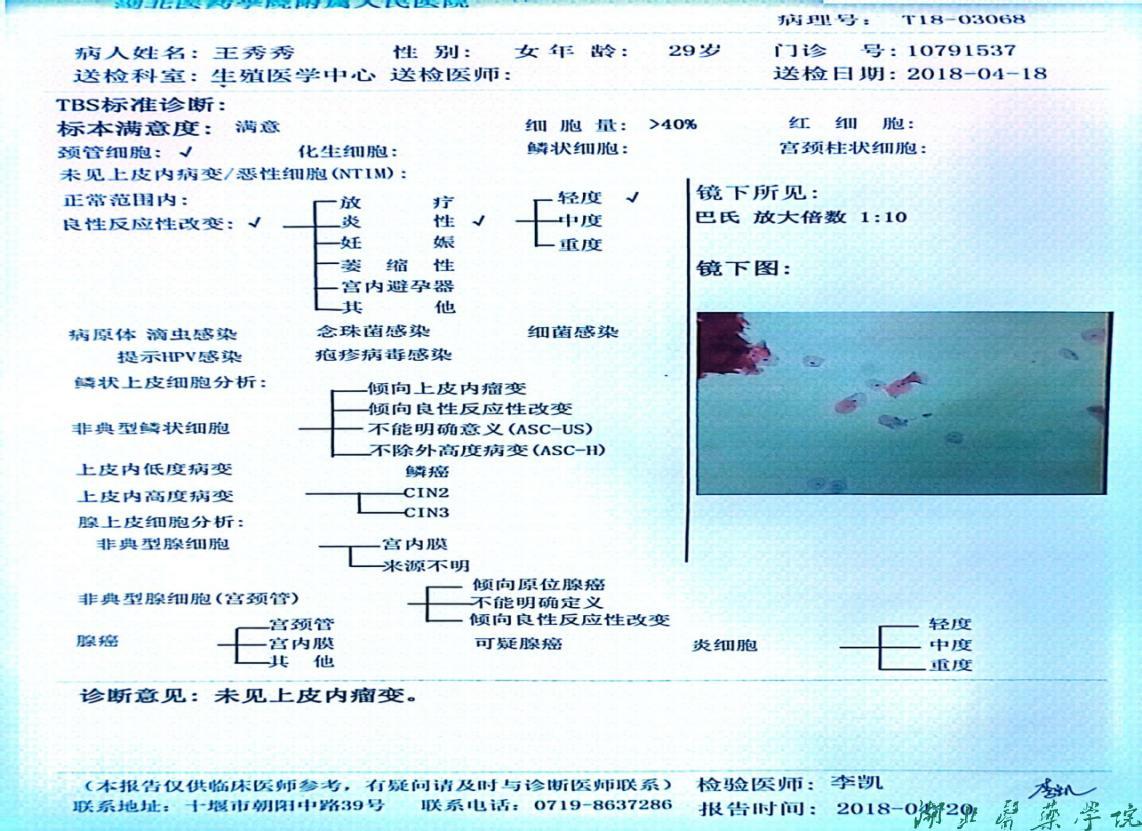
女方子宫内膜病理学检测(图4)
反复助孕失败基因检测报告:(图5)(知识点4)
#诊断:受精障碍
症状(诊断重要线索):反复助孕失败,无其他特殊症状
体征(诊断客观依据):均无特殊表现
辅助检查(诊断必要条件):
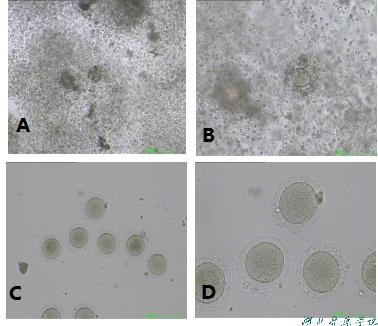
A受精障碍,卵子异常:男女双方常规检测均无异常,染色体正常,助孕手术取款当天体视显微镜观察到卵子形态学观察,透明带变性“蜡样改变”,卵子成熟度低,精卵结合无第二极体排除。
B反复助孕失败:外院多次助孕,病史提供诊断明确。
C原发性不孕症:女方未避孕未孕多年,病史提供诊断明确。
D输卵管梗阻:输卵管检查双侧不通畅,病史提供诊断明确。
#鉴别诊断:
A.精卵结合障碍:常规IVF中卵子形态和透明带正常,精子数量,活力正常,经过优化后的精子,加入卵子培养皿中,出现精卵不结合,未见第二极体排除。
B.反复胚胎质量低下:常规IVF中卵子形态和透明带正常,可正常受精,受精卵发生异常分裂,卵裂缓慢,细胞碎片多,发育阻滞。
#治疗原则:
治疗方案:ICSI助孕治疗,卵子激活(AOA)(知识点5)
手术取卵当天卵子形态(图6)
受精后胚胎培养情况(图7)

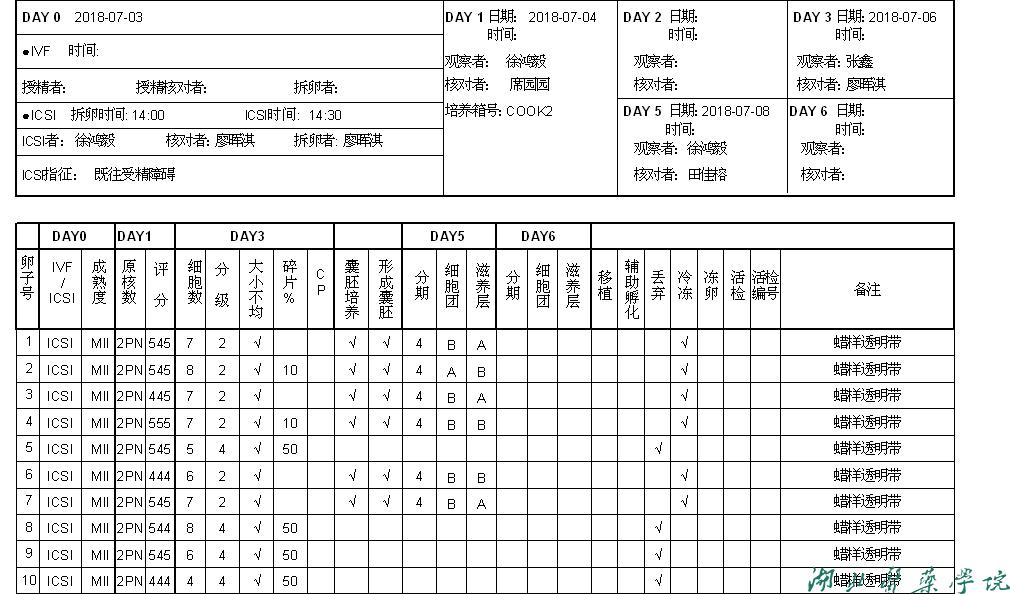
手术取卵当天的卵子受精卵、胚胎记录与评分(图8)
女方妊娠成功后检测
成功妊娠后随访情况(图9)
#总结与思考:
透明带形态异常是在辅助生殖技术中发生率占所有卵母细胞的2-5%。异常类型主要包括:颜色暗黑,透明带变薄或异常增厚,透明带双层或有夹层,透明带表面粗糙,毛刺或形状不规则,卵周间隙或透明带内有碎片等。根据中心的数据,“蜡样”透明带的卵子发生率在0.5%-1%,其主要表现卵母细胞全部或部分伴(不伴)小卵周间隙,透明带颜色致密,似‘蜡样’外观; 极体扁平或未见极体;ICSI注射时对透明带和卵膜渗透没有抵抗力,胞膜弹性差,抽吸过程中胞膜无阻力。是否伴有第一极体排出和胞质异常,是否有卵周间隙都具有个体差异性,但同一患者所有卵母细胞大部分均处于同一状态。分析了63位伴有卵周间隙狭窄、透明带质地不均患者受精方案和妊娠结局认为对于此类患者,ICSI操作是他们避免受精失败,获得成功妊娠的适宜方法,但部分患者卵子可能存在卵子激活障碍需要AOA增加其受精能力。
#知识点库
#知识点名称:知识点1:原发性不孕
#知识点标签(依据执考大纲):6.1.6
#易程度(A/B/C):A
#内容(文字、图片描述知识点内容):
根据病程:未避孕,至少一年没有受孕。
根据机制:育龄期夫妇,正常性生活,且无妊娠史。
#知识点名称:知识点2:ICSI的定义及适应证及技术操作
#知识点标签(依据执考大纲):6.1.6
#易程度(A/B/C):A
#内容(文字、图片描述知识点内容):
ICSI (Intracytoplasmic sperm injection)即卵胞浆内单精子显微注射技术,也就是第二代"试管婴儿",该技术是借助显微操作系统将单一精子注射入卵子内使其受精。
1.极度的少、弱、畸精子症(精子浓度<1×106/ml,或活力(PR)<1%,或正常形态率<1%);
2.严重的少、弱、畸精子症(精子浓度<5×106/ml,活力(PR)<10%,正常形态率<2%,以上三条具备两条及以上);
3.不可逆的梗阻性无精症;
4.生精功能障碍(排除遗传疾病所致);
5.免疫性不育,常规体外受精失败(IVF受精率﹤30%);
6.明确既往体外受精失败,或前次IVF受精率﹤30%;
7.精子顶体异常;
8.不明原因不育,常规体外受精失败(IVF受精率﹤30%);
9.需行植入前胚胎遗传学检查的;
10.既往IVF正常受精率﹤30%。
技术操作方法
1.ICSI前卵子的准备
(1)将已在37℃、6% CO2培养箱培养约2-4小时卵子吸入含透明质酸酶溶液的培养皿中,时间不超过30秒,用吸管吹吸卵子;
(2)将卵子移入含G-MOPSTMPLUS培养基的培养皿中用拆卵管轻轻吹吸,直至去除颗粒细胞;
(3)拆卵的动作应轻柔,速度应快,一般不超过1分钟;
(4)在倒置显微镜下评价卵子的质量及成熟度,确定第一极体是否存在;
(5)将挑选好的卵子吸到含G-MOPSTMPLUS培养基中。
2. ICSI培养皿的准备
取培养皿盖2个,用吸管吸取G-MOPSTMPLUS,做四个微滴在培养皿的正中,下面做PVP液滴内含少量的精子(ICSI时将卵子吸到G-MOPSTMPLUS微滴内供注射用),用平衡好的矿物油覆盖后,平衡30分钟后两个皿交替使用。



3. ICSI操作步骤
(1)安装、调节显微注射系统:检查显微镜恒热台是否设置在37℃。安装Holding和Injection针,调节显微注射装置,使其可灵活地控制抽吸精子。安装Injection针时应注意管道系统中有无气泡,如果有气泡将影响到显微注射的准确性。在低倍镜下依次调节Holding和Injection针的角度和位置,使其两个针头相对并与载物台平行(Injection和Holding针内矿物油应保留5-8 mm空气段,确保矿物油不直接接触培养液和配子);
(2)将Injection针降入ICSI注射盘PVP中吸入少量PVP,待针吸力达到平衡,移入另一含精子的PVP微滴中,选择形态正常的精子,用Injection针在精子尾部中段迅速制动。注意不要用力过猛,否则精子会粘附在培养皿底使吸取精子困难,或精子粘附注射针内腔;
(3)吸取被制动的精子,从尾部吸入;
(4)将Injection针移入含卵的微滴中,降下Holding针并轻拨动卵子,使其第一极体位于6点或12点处,这样可避免操作时损伤纺锤体,并固定住卵子;
(5)找准卵子的赤道线作为进针点,将Injection针中的精子推至针尖处;
(6)将Injection针从卵子9点钟处进入透明带,进一步向前推进,穿刺针穿入卵子直径约2/3处,同时需加负压,一旦刺破卵膜可见到胞浆和精子的快速返流的过程或卵膜回弹现象,之后将精子注入卵细胞内,尽量减少进入卵细胞中的PVP液;
(7)退出Injection针。退针时,Holding针保持原固定位置;
(8)退出Injection针后,检查穿刺裂孔形态。通常情况下,裂孔边缘呈漏斗状,指向卵细胞内,提示卵子的质量较好; 若卵膜的边缘是平坦的则胞浆可能流出,卵细胞也可能随之破裂,提示卵子质量较差;
(9)重复以上步骤至所有被选中的卵细胞均被注射。
4.注射后卵子的培养
将注射过的卵子在含G-IVFTMPLUS或GAMET BUFFER培养基中洗涤2次,移入另一含G-IVFTMPLUS培养基继续培养。ICSI 16小时后移入G-1TMPLUS培养基液滴中,在倒置显微镜下检查受精卵原核形态及数目。
5.受精率的计算
ICSI正常受精率=(D1出现2PN卵子数/注射MII卵子总数)X 100%
6.胚胎的换液、培养、观察、评价、移植等过程同IVF过程。
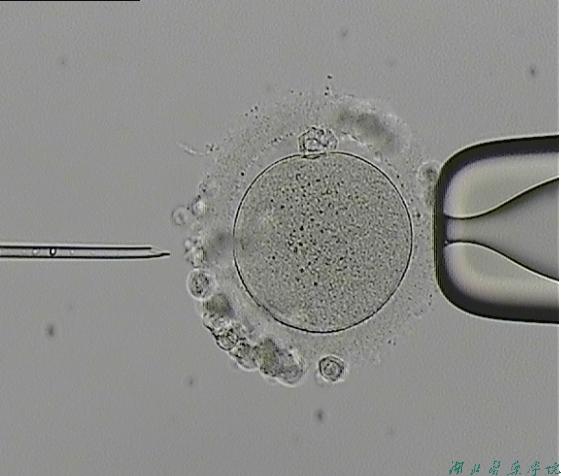
ICSI操作
#知识点名称:知识点3:补救ICSI
#知识点标签(依据执考大纲):6.1.6
#易程度(A/B/C):A
#内容(文字、图片描述知识点内容):
对可能有受精障碍的IVF患者,在常规IVF授精后4-5小时剥除颗粒细胞层,观察第二极体是否排出,如果所有成熟卵子的第二极体均未排出,或成熟卵子第二极体排出率<30%,半小时候后观察仍然没有变化即行补救ICSI,显微注射过程同普通ICSI。
#知识点名称:知识点4:反复助孕失败基因检测
#知识点标签(依据执考大纲):6.1.6
#易程度(A/B/C):A
#内容(文字、图片描述知识点内容):
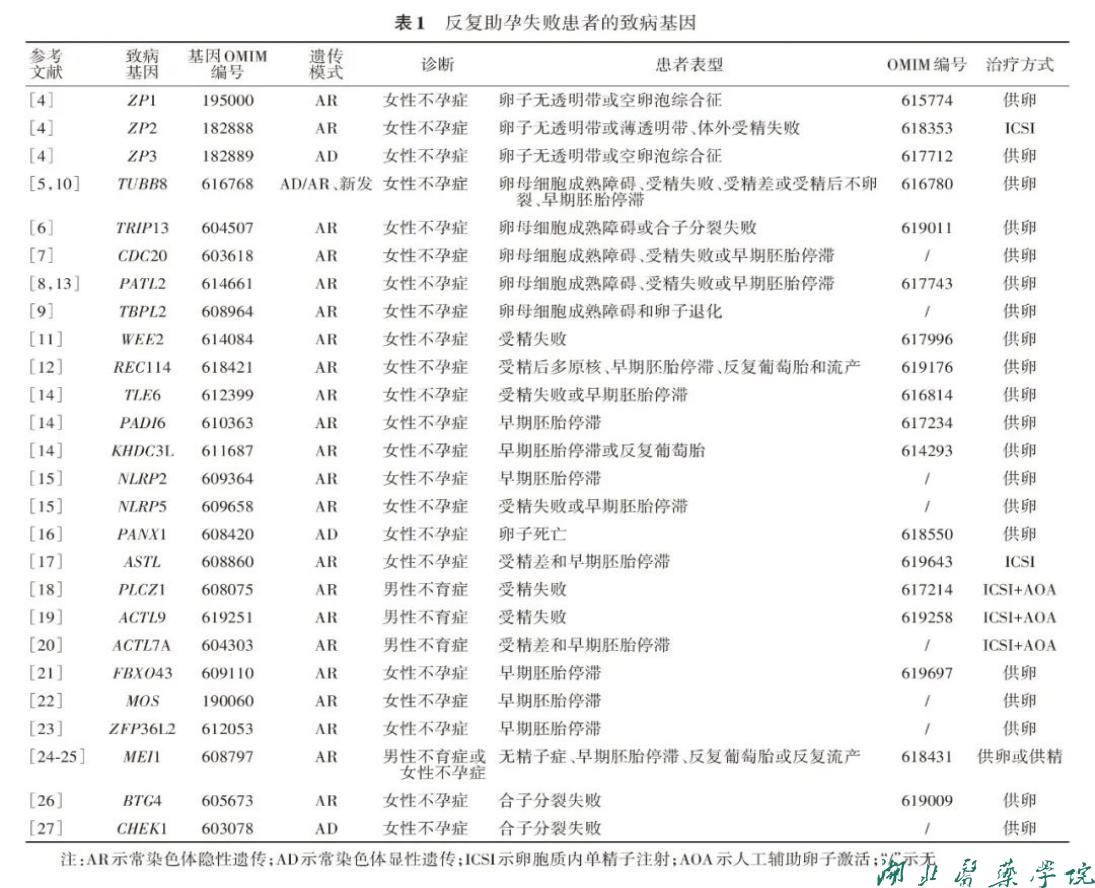
过去的几十年里,辅助生殖技术(ART)和基因检测技术都取得了一系列惊人的进步,为很多不孕家庭带来希望。在生殖医学中应用基因检测技术能够帮助患者寻找不孕不育症的原因,筛查可遗传给后代的疾病,以及优化ART。ART能够治疗输卵管堵塞、子宫内膜异位症、精子异常等引起的不孕不育症,并降低出生缺陷的发病率。然而在临床实践中,有部分女性不孕患者,经过多次IVF/ICSI尝试,仍无法成功妊娠,而现有的病史和诊断技术无法查明原因。此类原因不明的反复助孕失败可能是遗传因素所导致的,结合病史和仪器检查结果进行针对性的基因检测,将有助于不孕不育症的诊断和个性化治疗。反复助孕失败的母源效应基因参与调控卵子发生和早期胚胎发育过程,部分基因的突变或缺失会导致卵母细胞缺陷,进而影响早期胚胎发育。携带母源效应基因TLE6、PADI6、NLRP2、NLRP5、KHDC3L、FBXO43、MOS和ZFP36L2隐性突变的女性通常表现为早期胚胎停滞。另外,部分携带有REC114、CDC20或PATL2隐性突变的患者表现出早期胚胎停滞的表型。此外,一些携带有TUBB8突变的患者也表现为早期胚胎停滞。携带MEI1隐性突变的男性不育患者表现为无精子症,而女性不孕患者则表现为早期胚胎停滞、反复葡萄胎或反复流产。合子分裂失败是早期胚胎停滞的一种独特表型,表现为卵子受精后合子不卵裂。BTG4纯合突变导致患者合子内的母源mRNA降解异常,进而造成大量母源mRNA累积,最终导致合子分裂失败。CHEK1杂合突变会过度激活细胞周期检测点激酶,造成有丝分裂G2/M期阻滞和合子分裂失败。目前反复助孕失败患者的致病基因总结详见表1。
#知识点名称:知识点5:卵子激活(AOA)
#知识点标签(依据执考大纲):6.1.6
#易程度(A/B/C):A
#内容(文字、图片描述知识点内容):
单精子卵胞浆内显微注射(ICSI)是解决男性不 育的主要手段。自1992年第一例ICSI活胎分娩婴 儿出生以来,该技术得到广泛的临床应用,使体外受 精率提高到70%~80%,但仍有1%~5%的完 全或接近完全受精失败。导致ICSI受精失败的原因很多,多数学者认为ICSI后受精失败很大程度 上归因于卵母细胞激活失败。目前对ICSI受精失败的病例多采用人工卵母细胞激活(AOA)的方法。卵母细胞激活过程是一个多因素参与的复杂过 程。从卵母细胞角度来看,不能对精子诱导的激活产生反应和不能将精子核去浓缩形成雄原核,均被 称为卵母细胞激活失败,且激活失败的原因包括精子因素和卵母细胞因素。目前,在辅助生殖领域采用的AOA方法,与卵母细胞正常激活有所不同,多是人工诱导单一的Ca抖升高而无后续持续的Ca2+振荡,即仅仅人工诱导Ca2上升高来启动卵母细胞激活过程。
AOA的方法主要有三种:机械激活、电激活和化学激活。
1.机械激活:在ICSI操作过程中,采用显微注 射针抽吸卵母细胞靠近胞膜的胞浆,然后将抽吸的 胞浆连同精子一起注入卵母细胞中央,这种方法即AOA机械激活。这种激活方法可能对某些卵母细胞相关因素所致卵母细胞激活失败周期有效,在ICSI周期中常规使用这种方法并不能改善助孕结局。
2.电激活:外源性直流电引起卵母细胞膜蛋白的重排而形成胞膜孔道,细胞外的Ca2+通过孔道内 流进入胞浆,诱发细胞内Ca2+浓度升高,这种方法即AoA电激活。
3.化学激活:化学激活是ICSI受精失败周期 中最常用的AoA方法。其中,最常用的化学试剂 是钙离子载体,比如卡西霉素(A23187)和离子霉 素。钙离子载体是一种脂溶性的分子,能够通过卵 母细胞膜转运Ca2+,从而使细胞内Ca2上浓度一过 性升高。
#参考资料:
[1] 妇幼健康司.国家卫生健康委办公厅关于印发不孕不育防治健康教育核心信息的通知[EB/OL]. (2021-11-08)[2022-08-09].http://www.nhc.gov.cn/fys/s3581/202111/64f7b7f7ecb84abe91d8cb07f1cadbf1.shtml.
[2] Chambers GM, Paul RC, Harris K, et al. Assisted reproductive technology in Australia and New Zealand: cumulative live birth rates as measures of success[J]. Med J Aust, 2017, 207(3): 114-118. DOI: 10.5694/mja16.01435
[3] Visser L, Repping S. Unravelling the genetics of spermatogenic failure[J]. Reproduction, 2010, 139(2): 303-307. DOI: 10.1530/REP-09-0229.
[4] Zhou Z, Ni C, Wu L, et al. Novel mutations in ZP1, ZP2, and ZP3 cause female infertility due to abnormal zona pellucida formation[J]. Hum Genet, 2019, 138(4): 327-337. DOI: 10.1007/s00439-019-01990-1.
[4] Tavalaee M, Nasr-Esfahani MH. Expression profile of PLCζ, PAWP, and TR-KIT in association with fertilization potential, embryo development, and pregnancy outcomes in globozoospermic candidates for intra-cytoplasmic sperm injection and artificial oocyte activation[J]. Andrology, 2016, 4(5):850-856. DOI: 10.1111/andr.12179.